研究内容
2025年9月23日
大腸癌免疫微小環境研究グループ 笠島裕明、福井康裕
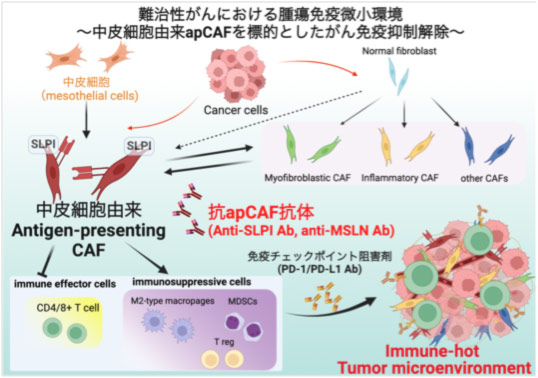
大腸癌は既存の遺伝子発現パターンに基づく大腸癌分子サブタイプ分類(CMS分類)が提唱され、中でも大腸癌全体の20-30%を占める間葉型(CMS4/iCMS3)の予後は極めて不良とされています。近年発展著しい免疫チェックポイント阻害剤などの免疫療法についても奏功率は低く、治療抵抗性メカニズムの解明が急務となっています。間葉型CMS4/iCMS3大腸癌では癌関連線維芽細胞 (Cancer-associated fibroblast; CAF)の活性化・集積によるimmune evasion(免疫逃避)が特徴と報告されていますが、CAFはその不均一性(heterogeneity)ゆえに治療標的とすることが困難です。近年、CAFの亜集団として抗原提示能を持つCAF (Antigen-presenting CAF; apCAF)の存在が報告されており、apCAFによる腫瘍抗原性調節が治療抵抗性に関与している可能性が考えられています。また、apCAFの起源として中皮細胞が提唱されております。 私たちは、apCAFが、癌微小環境において抗腫瘍免疫を抑制し、癌免疫治療抵抗性の原因を作り出している可能性を考え、新たな治療標的として大腸癌と関連について解明するための研究を進めています。
Colorectal cancer (CRC) has been stratified into consensus molecular subtypes (CMS) based on transcriptomic profiles, among which the mesenchymal subtype (CMS4/iCMS3) represents approximately 20–30% of cases and is associated with particularly poor clinical outcomes. Despite recent advances in immunotherapy, including immune checkpoint inhibitors, response rates in this subtype remain low, highlighting an urgent need to elucidate mechanisms underlying therapeutic resistance. Mesenchymal-type CMS4/iCMS3 CRC is characterized by immune evasion mediated by the activation and accumulation of cancer-associated fibroblasts (CAFs). However, the intrinsic heterogeneity of CAFs has posed a significant challenge to their effective therapeutic targeting. Recent studies have identified a subset of CAFs with antigen-presenting properties, termed antigen-presenting CAFs (apCAFs), which may regulate tumor antigenicity and contribute to resistance to immunotherapy. Furthermore, mesothelial cells have been proposed as a potential cellular origin of apCAFs. Based on these findings, we hypothesize that apCAFs play a pivotal role in suppressing anti-tumor immunity within the tumor microenvironment and in driving resistance to cancer immunotherapies. To address this, we are conducting studies aimed at elucidating the biological functions of apCAFs in CRC and exploring their potential as novel therapeutic targets.