研究内容
はじめに
生命現象は、ゲノム情報の主要な産物であるタンパク質によって支えられています。例えば、私たちは食事を摂ってエネルギーを得ていますが、その過程は、アミラーゼやシトクロムcといった酵素やタンパク質が働いています。北村研究室では、この「タンパク質」を遺伝子工学的な手法を用いて、「なぜそのような働きができるのか?」「もっと良いタンパク質はできないか?」「微生物や酵素を使って、有用な物質を効率よく作り出したり取り出したりできないか?」「もっと簡単にたくさんタンパク質は生産できないか?」といったことを考えています。具体的には「補因子」「抗体」「遺伝子工学」を主なキーワードとして、タンパク質の分子認識、Protein Engineering and Designの研究をしています。
研究テーマ1:フラビン誘導体結合タンパク質の構造機能相関
ビタミンB2に分類されるフラビンモノヌクレオチド(FMN)やフラビンアデニンジヌクレオチド(FAD)といった補因子が結合した黄色いタンパク質を研究しています。これらのタンパク質(や酵素)は、電子を受け渡しする反応を補因子に任せている訳ですが、では、残りの部分(アポタンパク質=ポリペプチド鎖)は何をしているのでしょうか?
考えられる仮説としては、
1. 補因子を「必要な時に」「十分な強さで」結合させる
2. 酸化還元電位(=電子の渡しやすさ)の制御
3. 正しい酸化還元パートナー(何から電子を貰って何に渡すか)の選択
といったことでしょうか。
そこで具体的に、FMN結合タンパク質やリボフラビン結合タンパク質、L-アスパラギン酸酸化酵素などを材料として、部位特異的変異法によってアミノ酸残基の置換体を作って、その酸化還元電位を測定したり、酵素活性を測定したり、フラビン誘導体との結合の強さを測定したり、結晶を作って立体構造解析をして、先ほどの仮説の検証をしています。この研究は、補因子が結合できなくなる、とか、電子の受け渡しがしにくくなるようなタンパク質阻害剤の開発に繋がり、難治療性微生物病の治療薬に応用できないかと考えています。

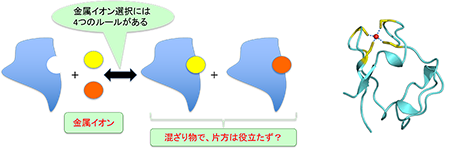
研究テーマ2:金属イオン結合タンパク質の構造機能相関
補因子として金属イオンを結合したタンパク質も研究対象にしています。研究テーマ1の成果から、「アポタンパク質には補因子が結合するためにちょうど良い空間あって、その空間に補因子が結合してタンパク質を安定化する」という仮説を持っていました。ところで、硫酸還元菌由来のルブレドキシンというタンパク質は通常鉄イオンを結合しているのですが、遺伝子工学的な手法を用いて大腸菌内で組換え体を作ってみると、鉄イオン以外に亜鉛イオンも結合していました。錯体の安定度定数に影響する因子は、
1. 配位子選択性
2. 配位立体構造
3. イオンの大きさ
4. pH
と言われています。結合する金属が決まっているとすれば、これらの条件だけでは、生体内におけるタンパク質の金属イオン選択性は説明できません(実験結果としては混ざり物だったのですから)。そこで、金属イオン結合タンパク質について「第5の因子」を見つけるべく研究しています。しかし、今は、「ルブレドキシンに分類されるタンパク質においては、結合できる金属イオンは1つではないが、生物は、その性質を積極的に利用しているのではないか?」という仮説を持っています。
今後は、この金属選択性を利用して、環境下から有害金属イオンを除去したり、有用金属イオンを回収したりするシステムに応用できないかと考えています。
これらのテーマ(研究テーマ1と研究テーマ2)は、「酵素の基質特異性」の研究に似ているかもしれません。高校の化学や生物で、酵素には基質特異性という性質があって、特定の基質としか反応しない、と習ったはずです。しかし、実際は、酵素によっては、似た基質とも反応することがわかっています。これらの研究テーマも、従来は特定の補因子や金属イオンとだけ結合する(補因子特異性とでも言いましょうか)と考えられていたのですが、必ずしもそうじゃない、ということを証明しようとしているのです。加えて、その曖昧さが持つ生物学的な意義は何か?(簡単に言えば、そんないい加減で生物は困らないの?)ということに着目して研究しています。
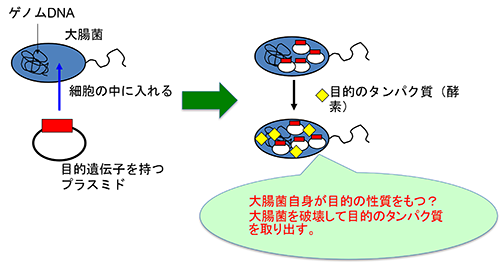
研究テーマ3:有用物質の遺伝子工学的生産
遺伝子工学を使って、有用物質を生産しようとしています。ある生物が持っている特徴的な性質は、その生物が持つ酵素によって成し遂げられています。その「設計図」は、その生物が持つ遺伝子です。例えば、良い香りや魅惑的な色をもつ植物は、その香りや色を作り出すように、植物の中でいろいろな化学反応が起こっています。それらの反応を触媒しているのが、酵素(群)です。ここでは、どんな有用物質を生産しようとしているかは明かせませんが、ある生物が持っている遺伝子を他の生物(例えば、大腸菌)に移植して、もっと簡単に効率よく有用物質を生産するシステムを作り出そうとしています。つまり、遺伝子組換え大腸菌自身が有用物質を作ってくれる、とか、その大腸菌から酵素だけを取り出して新たなバイオプロセスとするといった、有用物質の生産システムを構築することを考えています。また、その遺伝子に変異を加えて(=つまり、設計図を書き換えて)、目的の物質を効率的に作ることができる酵素に改変することも考えています。
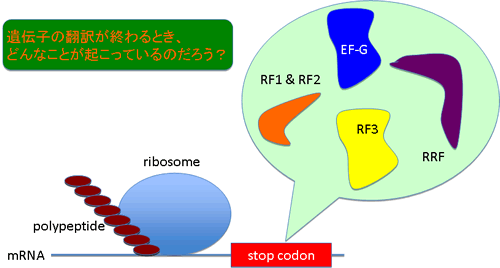
研究テーマ4:遺伝子翻訳終結因子
遺伝子の翻訳段階の研究はかなり昔から行われてきました。私見ですが、この研究はRNA研究者や遺伝学者が多く関わってきたので、それらの面からの研究は十分に行われているのですが、タンパク質科学の視点からの研究は十分ではないように思います。また、その「始まり」の研究はたくさん存在するのですが、「終わり」については研究が十分に行われていないように思います。そこで、遺伝子翻訳終結段階に関わるタンパク質(因子)をタンパク質科学的に研究しています。この研究は、今後、生体外タンパク質合成系をさらに効率化したり、非天然アミノ酸をタンパク質中に導入したりするといった応用に発展できると考えています。つまり、遺伝子翻訳が終わった時に、その反応に関わったパーツが、再び、そしてすぐに翻訳反応に使われれば、もっと短時間にたくさんのタンパク質を作ることができるでしょうし、遺伝子翻訳終結因子に工夫を加えれば、新たなタンパク質を作る事が出来るかもしれません(最近は研究していません💦)。
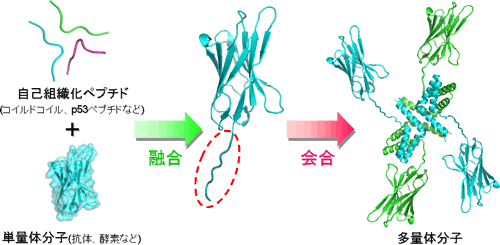
研究テーマ5:自己会合ペプチドを利用したタンパク質の高機能化
タンパク質の機能を人工的に高める方法の一つに「タンパク質同士をつなぐ」という方法があります。同じ機能のタンパク質だけでなく、異なる機能のタンパク質をつなぐことで、複数の機能を同時に発揮するタンパク質を作製することも可能です。では、どのようにしてタンパク質同士を連結すれば良いでしょうか?いくつかの方法がありますが、私たちは生体分子の持つ優れた自己組織化能(自発的に会合する能力)を利用しています。具体的には、自己会合する能力を持つ短いペプチドを遺伝子レベルで目的タンパク質に融合し、タンパク質レベルで自発的に会合させるという方法を使って、複数の小さなタンパク質ブロックから構成される複雑なタンパク質を作製することができます。私たちの研究では、目的タンパク質同士を簡単かつ安定につなぐことができる会合ユニットを開発するとともに、それらを利用することによって卓越した機能を発揮する人工タンパク質を作ることを目指しています。これらの研究は、安価で効果的なタンパク質医薬品の研究開発にも貢献できると考えています。
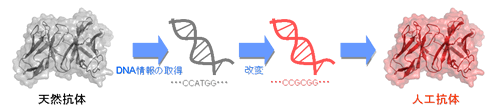
研究テーマ6:医薬応用を目指した高機能人工抗体の開発
抗体は免疫系(私たちの身体を細菌やウイルスなどの外敵から守る仕組み)で大切な役割を果たしているタンパク質の一つです。その特徴として、外敵(抗原)を見分ける能力(分子認識能)に優れているため、基礎から応用まで幅広い分野で利用されています。また、近年、がんやリウマチなど治すことが難しい病気の治療薬としても注目されており、副作用が少なく効果的な抗体医薬は難病で苦しむ多くの患者さんに福音をもたらしています。私たちの研究では、遺伝子工学的技術を使って、タンパク質の設計図であるDNA配列を編集し、天然には存在しない新しいタイプの抗体(人工抗体)を作製しています。さらに、抗体がどのようにして抗原を捉えているのかを、反応速度論解析、立体構造解析などを行うことで詳しく調べています。これらの研究を通じて、自然の仕組みに学ぶことによって、天然に存在する抗体よりも優れた機能を持つ人工抗体を設計し、高い効果を発揮する抗体治療薬を開発することを目指しています。