当科で行っている研究
当科では多くの臨床研究、基礎研究を行っていますが、代表的なものを紹介します。
臨床研究
移植後シクロホスファミド(posttransplantation cyclophosphamide: PTCy)によるGVHD予防法の我が国における臨床導入、および至適化に向けた研究
HLA半合致移植について
同種造血幹細胞移植は現在でも難治性血液悪性疾患を完治に導きうる有効な治療法です。HLA*適合血縁ドナーが同種造血幹細胞移植のドナーの第一選択となりますが、血縁者間に適切なドナーがいない場合には骨髄バンクでHLA適合非血縁ドナーをコーディネートすることになります。しかしながら病勢により至適な時期に移植を受けられないケースが少なからずあります。
HLA半合致ドナーとは2つのHLAハプロタイプのうち1つが合致しているドナーであり、親子では100%で半合致しており、同胞でも50%の確率で半合致しているため、患者さんの90%以上でドナーが見つかることになります。しかしながらHLA半合致移植(ハプロ移植)はHLAの不一致により重症の移植片対宿主病(GVHD)*や移植片の拒絶が生じる可能性があり、これまではGVHDの原因となるT細胞除去などの高価で複雑な操作や強力な免疫抑制療法を必要としてきました。一方で強力な免疫抑制療法やT細胞の除去は再発率を上昇させることになり、歴史的にさまざまなハプロ移植が試みられていましたが、一種のジレンマに陥っていました。
*HLA( Human leukocyte antigen):ヒト白血球抗原
*GVHD:graft-verus-host disease
PTCyハプロ移植について
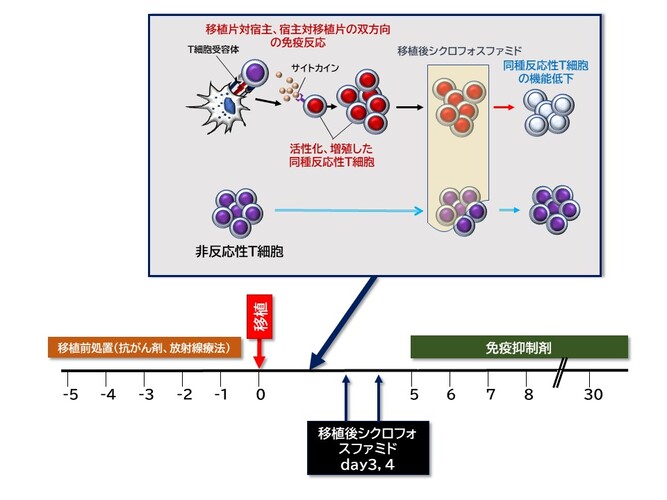
移植後シクロホスファミド(posttransplantation cyclophosphamide: PTCy)を用いたGVHD予防法 によるハプロ移植(PTCyハプロ)は、2002年に米国のJohns Hopkins Groupにより世界初の臨床研究が報告されました¹。 当初は移植後にシクロホスファミドを投与することによってGVHDや拒絶などの原因となる同種反応を示す有害なT細胞を選択的に除去すると考えられていましたが、最近の研究で 同種反応を示すT細胞は残存しており、その機能を低下させることが分かってきました²(図)。現在、PTCyの安全性、及び簡便性から国際的に広がりを見せており、同種造血幹細胞移植におけるドナープールの拡大に大きく寄与しています。
(参考文献)
1. Biol Blood Marrow Transplant. 2002;8(7):377-86.
2. J Clin Invest. 2019;129(6):2357-2373.
当教室で行っているハプロ移植研究について
我々は我が国で初めて臨床研究として2010年1月にPTCyハプロを行いました1)。その後2022年12月までに190例近いPTCyハプロを行ってきました。そして、これまでの臨床研究において、移植片に含まれる造血幹細胞数が移植後の予後に大きな影響を与えることを解明しました2)。また、KIR2DS1陽性ドナーからのPTCyハプロが移植時寛解例において再発の抑制に有意に寄与していることを報告しました3)。さらにNKG2D一塩基多型である、rs1049174 CCドナーからのPTCyハプロが再発/進行のリスク低下と関連していることを実証しました4)。また近年 HLA適合血縁者・非血縁者間においてもPTCyによるGVHD予防が有用であることを我が国で初めての前向き研究として報告しました5)。
現在、PTCyハプロにおける最適なドナーに関する特定臨床研究「造血器悪性腫瘍に対する最適ドナーを考慮した移植後シクロフォスファミドを用いた血縁HLA半合致移植」を行っています(jRCTs051190011)。さらに PTCyをHLA不適合非血縁間移植への拡大を目的とした「HLAミスマッチ骨髄バンクドナーからの同種造血細胞移植における移植後シクロホスファミドを用いた GVHD予防法の安全性と有効性に関する臨床第 II相試験」の特定臨床研究(jRCTs051220057)も施行中です。今後PTCyハプロにおける至適条件の確立に向けて精力的に研究を行っていく予定です。
(参考文献)
- Nakamae H, et al. HLA haploidentical peripheral blood stem cell transplantation using reduced dose of posttransplantation cyclophosphamide for poor-prognosis or refractory leukemia and myelodysplastic syndrome. Exp Hematol (IF: 3.08; Q3). 2015 Nov;43(11):921-929.e1. doi: 10.1016/j.exphem.2015.07.006. Epub 2015 Aug 15. PMID: 26284307
- Nakamae H, et al. A Prospective Study of an HLA-Haploidentical Peripheral Blood Stem Cell Transplantation Regimen Based on Modification of the Dose of Posttransplant Cyclophosphamide for Poor Prognosis or Refractory Hematological Malignancies. Cell Transplant (IF: 4.06; Q3). 2022 Jan-Dec;31:9636897221112098. doi: 10.1177/09636897221112098. PMID: 35906755
- Ido K, et al. Donor KIR2DS1-Mediated Decreased Relapse and Improved Survival Depending on Remission Status at HLA-Haploidentical Transplantation with Post-Transplantation Cyclophosphamide. Biol Blood Marrow Transplant (IF: 5.74; Q2). 2020 Apr;26(4):723-733. doi: 10.1016/j.bbmt.2019.12.765. Epub 2019 Dec 31. PMID: 31899360
- Ido K, et al. Effect of Donor NKG2D Polymorphism on Relapse after Haploidentical Transplantation with Post-Transplantation Cyclophosphamide. Transplant Cell Ther (Report missing IFs). 2022 Jan;28(1):20.e1-20.e10. doi: 10.1016/j.jtct.2021.09.019. Epub 2021 Oct 1. PMID: 34607074
- Nakamae H, et al. A phase II study of post-transplant cyclophosphamide combined with tacrolimus for GVHD prophylaxis after HLA-matched related/unrelated allogeneic hematopoietic stem cell transplantation. Int J Hematol (IF: 2.49; Q3). 2022 Jan;115(1):77-86. doi: 10.1007/s12185-021-03228-1. Epub 2021 Sep 29. PMID: 34586587
基礎研究
血液腫瘍動物モデルを用いた研究
<ロペグインターフェロンの抗腫瘍メカニズムの解明>
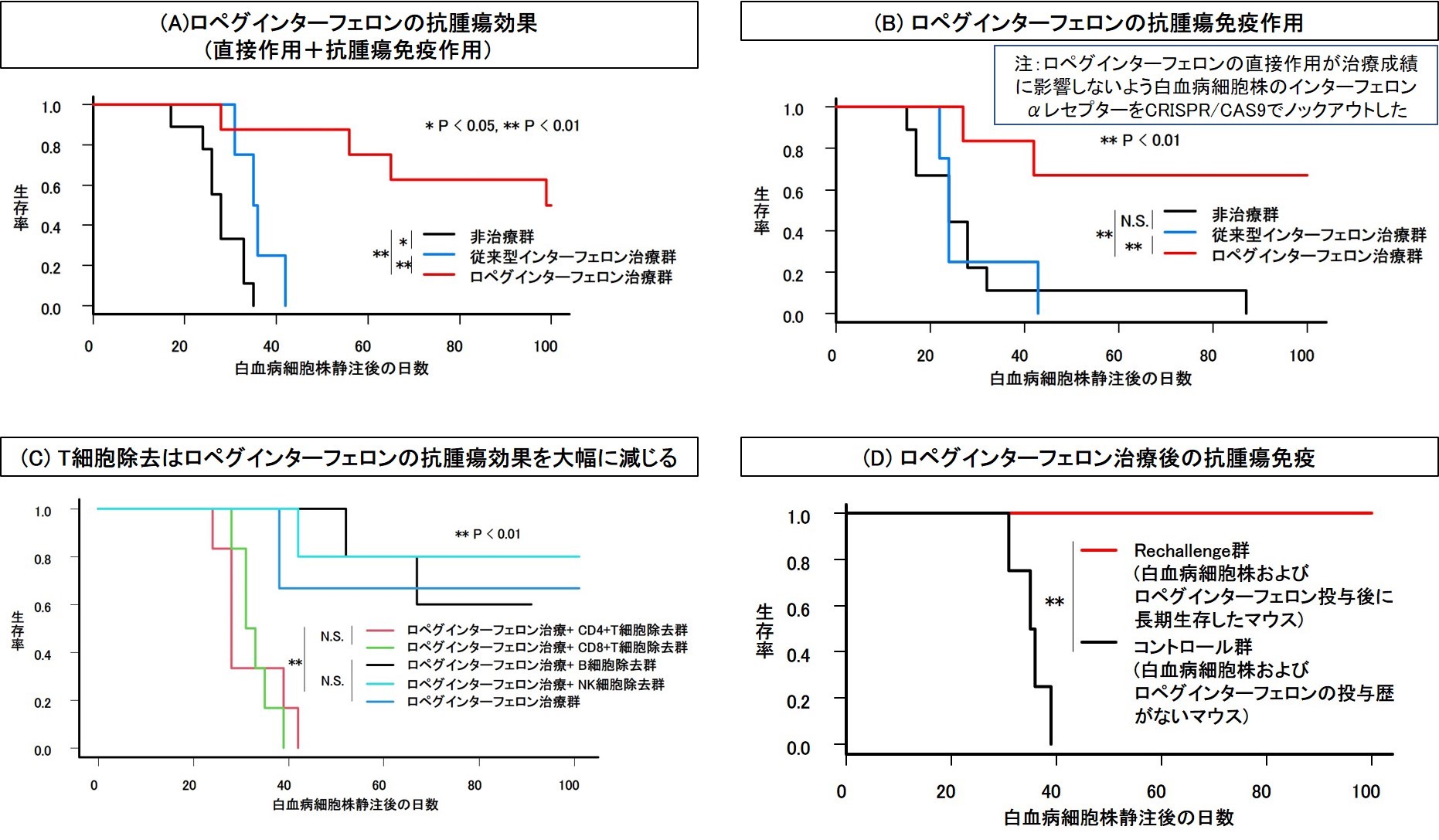
ロペグインターフェロンは、体内での消失半減期が長く、頻回の投与を必要としない新規のインターフェロン-α製剤です。近年、血液がんの一種である骨髄増殖性腫瘍を分子学的寛解へ導く可能性があることが示されています。
インターフェロン-αのがん抑制における機能のメカニズムは、①腫瘍細胞にアポトーシスや細胞分裂の停止を誘導する直接効果、②宿主の免疫細胞を活性化することにより腫瘍を体内から排除する免疫調整作用に大別されます。しかし生体内においていいずれが重要なのか、従来のインターフェロンαならびにロペグインターフェロンとも明らかでありませんでした。我々はインファーフェロンαの抗腫瘍作用機序について直接作用および免疫調整作用の両側面から検討しました(Cancer Sci. 2022;113:2246-2257)。免疫抑制処置を行う必要なくC57BL/6(B6)マウスに生着する白血病細胞株を用いて独自の白血病マウスモデルを作成し、①ロペグインターフェロンは従来のインファーフェロンαより白血病マウスの生存期間を有意に延長すること (下図A)、②抗腫瘍免疫作用がロペグインターフェロンの主要な抗腫瘍機序であること(下図B)、③T細胞がロペグインターフェロン治療において重要な働きを担うこと(下図C)、ロペグインターフェロンにより腫瘍が排除された生体内で記憶免疫が誘導されること(図D)を明かにしました。