乾燥の化学と環境への影響調査
乾燥の化学と環境への影響調査
ある固体の電解質を水に溶かし、その後乾燥させます。100℃で瞬時に乾かすと電解質が析出。でも、室温でゆっくり乾燥させると・・・・ 酢酸アンモニムで行うと、すべて気体になりました。なぜ?環境中ではどんな役割が?
室温 100℃
酢酸アンモニウム水溶液の乾燥
雨は大気の掃除屋と言われています。ガス状汚染物質、PM2.5の様々な粒子が雨により大気から除去されます(Wash outといいます)。水は非常に優れた溶媒です。大気中に浮かんでいる雲は生成するときに汚染物質を溶かし(Rain outという)、浮かんでいるときにも周りの物質をどんどん溶かしこんでいます。雲は必ず雨になるとは限りません。平均すると6回から10回雲生成と乾燥を繰り返した後、雨になって落ちてきます。雲になった時に取り込まれたモノは、乾燥するとどうなるのでしょうか?1)元通りの物質となって大気に戻る、2)塩になって析出する、3)元とは違う組成の気体、または塩になる。というように雨の中でどんな組成になっているかで運命が変わってしまいます。ざっとまとめると
酸性溶液
硫酸イオン: 揮発性のある化合物がほとんどないので塩として析出するか、硫酸の液滴になります。
弱酸イオン: 硫酸イオンが存在すると、水素イオン濃度の分だけ硝酸ガスとなります。ただし、硝酸はいろんなものにくっつきやすいので100%が気体になるわけではなく、一部は残ってしまいます。
塩化物イオンや揮発性の弱酸イオン: 水素イオン濃度の分だけ気体となります。
中性~アルカリ性溶液
硫酸イオン: 塩になります
弱酸イオン: 組成と弱酸の種類 (揮発性かどうか) によって塩になるか気体になるかが決まります。pHは関係がありません。
揮発性の場合は次のような規則があります。

(ただし、2価のイオンの濃度は2倍に、3価のイオンの濃度は3倍にします)
ΔCA ≧ 1 のとき: 弱酸イオンは塩なって残ります。
ΔCA ≦ 1 のとき: 弱酸イオンはH+と結合し,気体になります。
0 ≦ ΔCA ≦ 1 のとき: ΔCAの値に応じて、塩になって残る割合が決まります。
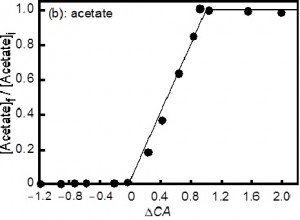
弱酸の残存比とΔCAの関係
図で表すと上図のようになります。このΔCAは何を意味するのでしょうか?まず、不揮発性カチオンとは、中性からアルカリ性の条件では、塩になったときに、相手のイオンの種類に関係なく揮散しない陽イオンのことで、Na+、K+、Ca2+、Mg2+などが相当します。不揮発性アニオンとは、中性からアルカリ性の条件では、塩になったときに、相手のイオンの種類に関係なく揮散しない陰イオンのことで、SO42-、NO3–、Cl–(アルカリ性や中性条件では揮散しにくいので、ここでは不揮発性に入れています)などが相当します。ということは、ΔCAの式の分子の項は不揮発性カチオンと不揮発性アニオンの濃度の差になりますから、まず、不揮発性カチオンと不揮発性アニオンが結合して塩となり、残った不揮発性カチオンの濃度が、揮発性の弱酸と同じ濃度であれば、弱酸は不揮発性カチオンと結合するために全て塩として残ります。一方、不揮発性カチオンと不揮発性アニオンが結合して塩となった後、不揮発性カチオンが溶液に残っていなければ、揮発性の弱酸は水素イオンと結合するしかないので、全部気体になってなくなるということになります。 ところが亜硝酸イオンはもっと面白いんです!塩として残る分は上と同じです。でも、気体になる方は、全て亜硝酸ガスというわけではないんです。亜硝酸が関与する反応は、結果から考えると大体次の3つの反応になります。
NH4NO2 → N2↑ + 2H2O (アンモニアに一次、亜硝酸に二次の三次反応)
2HNO2 → NO↑ + NO2↑ + H2O (二次反応) NH4NO2 → NH3↑ + HONO↑ (一次反応)
これらは反応の次数(反応に何分子が関与するか)が異なります。乾燥が起こると溶液は高濃度になります。体積が100分1になると、1次反応の速度は100倍の速さに、二次反応は1万倍に、三次反応は100万倍の速さになります。速度定数にもよるのですが、上の例の場合、ゆっくり乾燥すると、気体になって出て行く分が多く、そうなると乾燥が起こっても濃度は高くなりません。溶液からなくなってしまうからです。ところが速く乾燥すると、溶液からなくなる前に高濃度になるので、三次反応の窒素になる反応が一番速くなります。乾燥速度が変わると結果が変わる。温度とか水滴の大きさによって運命が変わるということなんです。自然って面白いと思いませんか?
大気中から水滴に取り込まれた窒素酸化物成分が乾燥すると窒素に変化する。すると大気の光化学反応に影響を与え、例えばオゾン濃度が低く抑えられるようになります。シミュレーションやモニタリングデータではその様子を確認できます。 今は、水の存在でオゾンがどうなるかを調べているところです。
