凍結で進む化学反応とそのメカニズムの解明
凍結で進む化学反応とそのメカニズムの解明 (Multi-phase Chemistry)
冷凍庫で溶液を凍らせると、25℃の部屋に置いておくより、劣化が速い!!そういうこともあります。なぜ?環境中ではどんな役割が?
その前に環境中ではどんな時に凍るのでしょうか?ⅰ)雲粒ができるとき、ⅱ)凍雨、ⅲ)夜、生成した露が夜中に凍結、ⅳ)河川や湖の凍結。などいろんな場面で溶液が凍ります。冷凍庫以外でも、ほんとありふれた現象なんです。
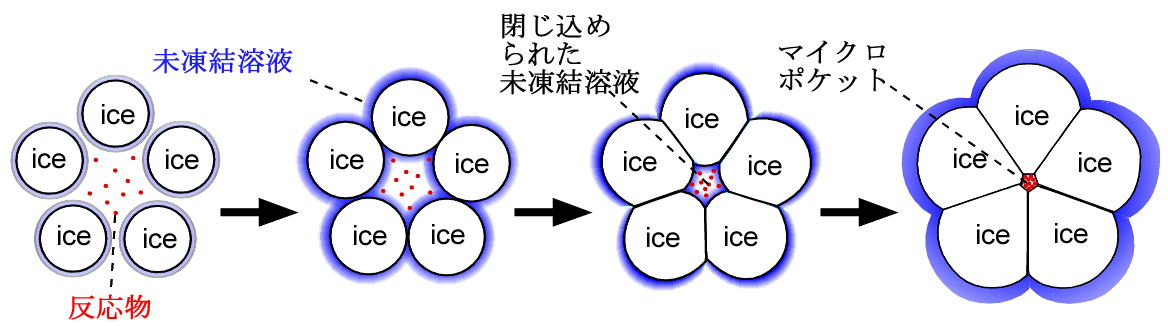
水溶液を凍結すると多くの氷結晶が成長します。その時、氷は自分の結晶のネットワークの中に他分子を取り込むことを極端に嫌います(これは氷に限らず一般的にあてはまります)。その結果、氷溶液界面に存在する未凍結溶液中の溶質濃度が高くなります。氷が成長すると、その濃度はどんどん上昇してきます。さらに氷が成長すると、どこかで氷の間に溶質が取り囲まれます。さらに氷が成長すると、この溶質の濃度はどんどん高くなり、その結果反応が速くなります。
凍結濃縮による反応促進機構の概念図
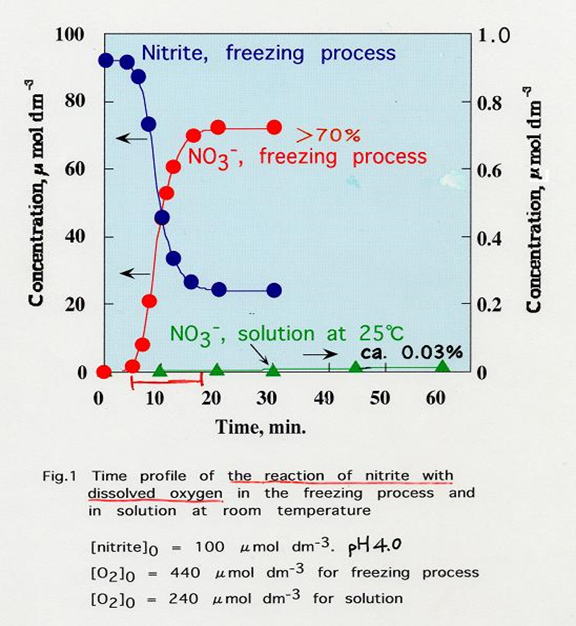
例えば、亜硝酸と溶存酸素の凍結による反応(-20℃)は、溶液中(25℃)よりも20万倍も速くなります。
亜硝酸と溶存酸素の反応
このように凍らせると反応が速くなるのは本当なんです。でも、図1.1のメカニズムで反応が速くなるなら、全ての反応が速くなりそうですが、実際はある限られた反応だけが凍結で速くなります。何がキーポイントになっているのでしょうか? 反応を速くするには、一般に温度を高くするか濃度を高くするかです。凍結させるということは温度は下がるので、濃度の変化が重要になってきます。
なぜ凍結すると反応が速くなることがあるのか?
水に何かを溶かすと濃度が高くなるにしたがって、凝固点が下がってきます。凝固点降下といいます。濃度と温度には関係があります。例えば5Mの溶液は大体-10℃で凍結しますが、初めの溶液が5Mなら-10℃で凍結した時の未凍結溶液の濃度はほぼ5Mで濃縮率は1です。ところが、初めの溶液が5 mMなら-10℃にすると1000倍も濃度が高くなります。反応の速度は濃度に依存しますから、凍結で濃度が高くなればその分反応も速くなるのです。つまり、濃縮される程度がどのくらいかが重要なので、全体の濃度が初めから高濃度、例えば1 Mもあるような溶液は反応は速くならず、希薄溶液でのみ見られる現象なのです。環境中の水の濃度は海水など特別なものを除き希薄溶液ですので、環境中では凍結で反応が進むことがよくあります。 また、多くの化学変化はその物質の濃度に比例する変化をします。一次反応といいます。凍結ではこのような反応は速くなりません。反応は衝突で起こりますが、2分子が同時に反応に関与するときは濃度の二乗に比例して速くなります。3分子が同時に反応に関与する場合は3乗に比例します(4分子はほとんど知られていません)。これらの高次の反応が凍結すると速くなるのです。 このような考えを数式にすると、実験結果をうまく説明できることがわかりました。さらに、その式を変形すると、凍結反応で活性化エネルギーを求めることができることもわかりました。この方法は世界初です。
このように、わからない現象も一つ一つ解明し、モデル化し数式を立てると、これまで見えてこなかった新たな現象を発見する可能性が出てきます。
まだまだあります。氷のネットワークには他分子は入りにくいと書きましたが、実は少しは氷のネットワークをだまして潜り込むことができます。ところが、この潜り込み方がモノによって違うのです。例えば、NaCl水溶液を凍らせると、Cl–の方がNa+より多く氷に取り込まれます。すると、氷がマイナス、未凍結溶液がプラスの電荷を帯びます。つまり、氷-溶液界面に電位が発生します。文献を見ると-100ボルトから+200ボルトもの値が報告されています。電気化学反応の可能性もあります(まだ証拠を示した論文はありません)。 発生した電位はいつまでも安定なわけではなく、氷の中をプロトン(H+)や水酸化物イオン(OH–)が移動し電位を緩和します。その結果、未凍結溶液のpHが上がったり、下がったりします。酸性で安定な物質をNaClを入れて凍らせると、未凍結溶液のpHがアルカリ側まで変化し、分解するという現象を見つけました。溶液だと安定なのに凍らせると分解してしまったんです。その原因がpHの変化でした。
凍結反応はこれら以外にも知られていて、まだ完全にはすべてのメカニズムは解明されていません。いつか解明される日が来ると思いますが、その中に自分のやった研究が一つでも多く関わることができたらと、これからも研究を続けていきます。