最新の研究成果
光の力で抗原抗体反応を加速! 2京分の1グラムの微量タンパク質を3分で検出成功
2022年10月6日
- プレスリリース
- 理学研究科
ポイント
◇光の力※1により、分子認識機構※2の一種である抗原抗体反応を加速する新原理を発見。
◇レーザー光を3分照射するだけで数十アトグラムの極微量タンパク質を検出可能。
◇がん、認知症、感染症などさまざまな病気の超早期診断にも応用可能。
概要
大阪公立大学 研究推進機構 協創研究センター LAC-SYS研究所の飯田 琢也 所長、床波 志保 副所長らの研究チームは、生体中の分子認識機構※2の一種である抗原抗体反応の光誘導加速※3に関する新原理を発見しました。
本研究は、標的タンパク質とこれに選択的に結合する抗体を修飾したプローブ粒子を人間の毛髪や細動脈と同程度の幅の流路に導入し、赤外レーザー光をわずか3分間照射することで従来のタンパク質検査技術の約100倍の高感度の検出を可能とし、数十アトグラム(ag = 10-18g、100京分の1グラム)レベルでの迅速微量計測に世界で初めて成功しました(図1)。今回計測した最小濃度0.31pg/mLのタンパク質分散液の場合、濃度と測定領域を通過した液量(300nL)から換算して46.5ag(約2600個)、つまり2京分の1グラムの標的タンパク質をわずか3分間で計測できたことに相当します。タンパク質は遺伝子(DNA, RNA)のようにPCR法で増幅ができませんが、狭小空間に閉じ込めてレーザー照射するだけの簡単な操作によって濃縮し反応を加速させることで、迅速かつ高感度の検出ができることを実証しました。
本研究成果は、2022年10月6日、「Communications Biology」にオンライン掲載されました。
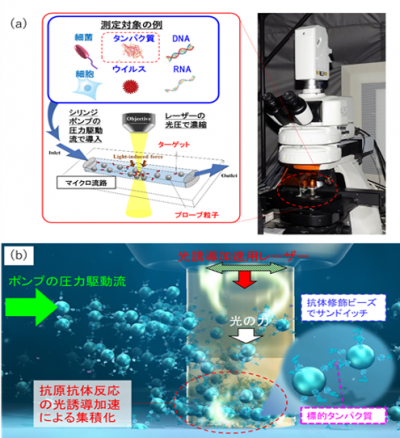
図1:(a)マイクロフロー光誘導加速システムの概略
(b)タンパク質を微量検出する原理のイメージ
抗原抗体反応は生体の防御機能である免疫に関する極めて重要な生化学反応です。床波副所長との物理・化学・生物の分野を超えた共同研究を通じて、歴代の大学院生達や研究員の協力も得て、この反応を光の力で制御する新原理を解明しました。特に、レーザー照射するだけで高感度・迅速に微量マーカーの計測ができ、超早期診断の革新に繋がると期待しています。

飯田琢也 教授/所長
研究の背景
がん、認知症、微生物感染症など多くの疾患の早期診断法の一つとして、抗原抗体反応に基づく検査法(イムノアッセイ)による微量タンパク質の分析が重要な役割を果たしています(たとえば、人間ドックの各種がんを対象とした血液検査や、新型コロナウイルスの抗原検査でも抗原抗体反応が使われています)。しかし、タンパク質はDNA検査で用いられるPCR法のような増幅が困難であり、インキュベーション(抗原抗体反応を静置して待つ工程)や洗浄など複雑な処理が必要かつ、熱に弱いという課題がありました。従来からさまざまな検出法が考案されていますが、たとえば、新型コロナウイルス感染症の抗原検査などに用いられる汎用的なイムノクロマト法(抗原抗体反応を用いた簡便、迅速な検査方法の一つ)では感度が低く、研究現場で用いられるELISA法(enzyme-linked immunosorbent assay, 酵素結合免疫吸着法)は高感度ではあるものの工程数が多く、全工程で5~6時間を必要としていました。また、研究チームによる従来の光濃縮の研究では、光の力で捕捉した金属ナノ粒子集合体の発熱効果による対流(J. Phys. Chem. C 2014)と圧力駆動流による補助の下、5~10分の短時間でフェムトグラム(fg=10-15g、1000兆分の一グラム)オーダーの微量タンパク質の計測に成功(APL Photon. 2019)していましたが、熱によるタンパク質の変性が課題でした。
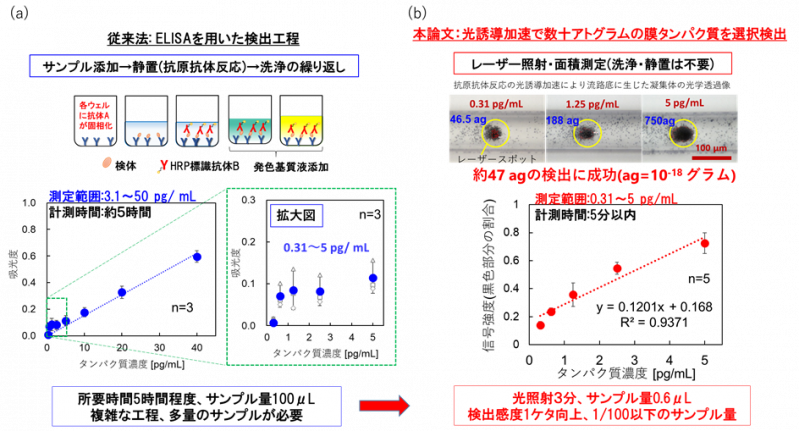
図2:(a)従来技術としてのELISA法の工程と測定例。吸光度で評価。(b)本論文で解明したマイクロ流路中での抗原抗体反応の光誘導加速の原理を用いたタンパク質の微量検出の測定結果。多層部分の割合を評価。
研究の内容
本研究では、人間の毛髪(太さ70~80μm)や細動脈(直径100~200μm)とほぼ同程度の幅のマイクロ流路中(本論文では流路幅100μmを使用)にレーザー照射し、光の圧力により標的分子とプローブ粒子の衝突確率を高めることで、液体試料を含む流路の底面など固液界面における微量タンパク質(アトグラムレベル)の抗原抗体反応を捕捉する光誘導加速の新原理を提案しました(図2、図3)。この原理を、複数種類の膜タンパク質に適用したところ、ある種の膜タンパク質では わずか3分間のレーザー照射により、300nL(1 nLは1 mLの100万分の1、つまり300 nLは1 cm角のサイコロの体積の約333分の1)の微量サンプル中で47-750 agの標的タンパク質の検出に前処理を一切行わず成功しました。
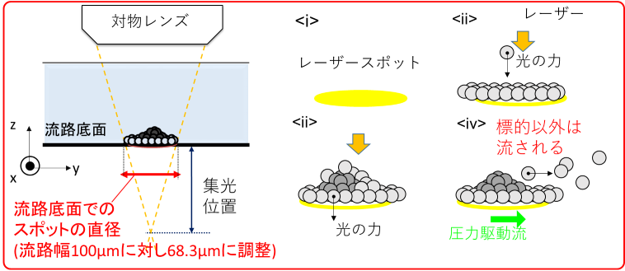
図3:デフォーカスしたレーザースポット径で抗原抗体反応を加速し、プローブ粒子とタンパク質3次元的な集合構造を形成する過程の概念図。
この結果は、従来のインキュベーションや洗浄などの多工程のために検出に数時間を要するELISAなどのタンパク質検出法に比べ、サンプル量100μLの約300分の1以下かつ、約100倍の高感度と超高速特異検出を実現したことを意味します。本成果は、生体内の細胞や組織におけるタンパク質の構造・機能を総合的に研究する学術分野であるプロテオミクスの発展や、多様な生化学反応の制御によるハイスループットなバイオ分析の革新的なプラットフォーム構築を促進し、がん・認知症・微生物感染症などのさまざまな疾病の超早期診断に関する新機軸を与えるものです。
研究手法
100μm程度の幅のマイクロ流路中に同程度のスポット径70μm程度にデフォーカスした数百mW程度のレーザーを照射することで光の圧力により標的分子とプローブ粒子の衝突確率を高め、固液界面における微量タンパク質の抗原抗体反応を捕捉する光誘導加速の新原理を提案しました。より具体的には、赤外光吸収による熱発生が少なく光散乱が強い直径2μmのポリマービーズを用いて光の力の成分である「散乱力」を増強して圧力駆動流でスポットに誘導された抗体修飾ビーズと標的タンパク質に熱的ダメージを与えずに集積することを可能としました。
具体的なターゲットタンパク質は膜タンパク質の一種であるCD80とCD63/CD9複合タンパクを用いました。CD80は、抗原提示細胞やナチュラルキラー細胞に発現する膜貫通型タンパク質で、T細胞(生体の防御機能に関するキラーT細胞とヘルパーT細胞の2種類に大別される)の活性化と不活性化を制御することが知られています。CD63およびCD9は癌細胞由来のマーカーナノ粒子(細胞外小胞)の表面に多く発現している膜タンパク質として知られており、CD63/CD9複合タンパクは細胞外小胞の検査キットの標準試料として用いられています。
特筆すべき点として、圧力駆動流の流量と光の力のバランス制御が本研究の要となりますが、多くの条件検討を行い、100~200 μm/sの流速となるように調節することで効率良く抗原抗体反応が促進されることを明らかにしました。また、レーザー照射下で得られた構造体の一部では多層化により透過光が遮られたために黒色部分が形成され、その面積がタンパク質濃度と正の相関があることを見出しました。抗原抗体反応による結合を凝集エネルギーという物理量を用いて表現したモデル計算により、上記のような多層化が光の力と圧力駆動流によって生じることを理論解析でも確認しました(図4)。
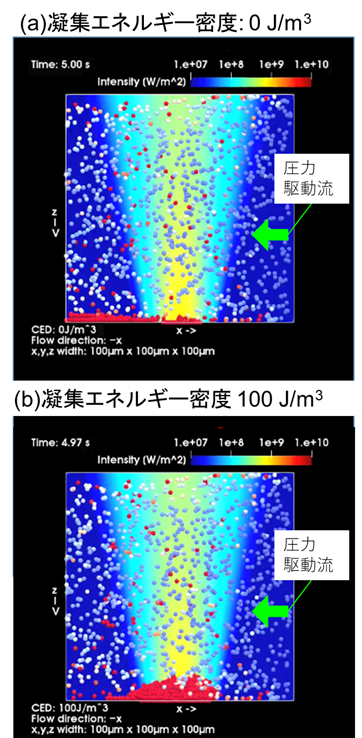
図4: マイクロフロー光濃縮のシミュレーション結果。(a)標的タンパク質との結合なし、(b) 標的タンパク質との抗原抗体反応あり
本研究では、飯田所長と床波副所長が共同で研究を開始し、研究デザインに等しく貢献しました。浜谷 翔大氏(飯田研究室で2020年修士取得)、飯田所長、床波副所長はマイクロフロー光濃縮の実験を遂行し、高木 裕美子研究員、藤原 佳奈大学院生(大阪府立大学大学院理学系研究科 博士前期課程2年)は比較実験としてのELISAなどを遂行しました。田村 守特任講師と飯田所長は理論計算を実行しました。
ブレークスルーのポイント・苦労した点
飯田所長が専門とする生体光物理と床波副所長が専門とするバイオ分析化学の分野を超えた共同研究であり、手法の開発や現象の理解に長い年月を要しました。また、レーザーで光濃縮して得た集合体のサイズとタンパク質濃度との間の相関についても予想外の現象が色々と起こりました。一足飛びではなく、流路幅とレーザースポット径の組合せを様々に変化させるなど地道な条件検討の積み重ねにより問題を解決することができました。
特に、「人間の血管程度の流路の中に抗体修飾ビーズと測定対象のタンパク質を導入してレーザーによる光圧で濃縮すると、相互作用確率を高めて抗原抗体反応を加速できるはず」という基本的なアイデアから出発し、5~6年に渡る歳月を経て、物理化学的アプローチで実験結果を地道に蓄積してきたことが今回の成果につながりました。また、シスメックス株式会社からサンプルの一部をご提供いただき、取扱い方をご教示頂いたことも本研究の成功の基礎となりました。原点に立ち戻り、熱の効果を排除して「光圧と流体圧力の相乗効果」に関する地道な基礎研究より抗原抗体反応の制御に成功し、アトグラムレベルという極微量のタンパク質の検出に成功しました。
期待される効果・今後の展開
本成果は、1滴の血液など微量の体液から、がん・認知症・微生物感染症などに関連する物質の検出や新規疾患マーカーの発見を促進し、さまざまな病気の超早期診断システムの開発にブレークスルーを産み出す可能性を示唆するものです。現在、国立研究開発法人科学技術振興機構(JST)未来社会創造事業のプロジェクトの中で、医療機関と患者由来サンプル中のがんマーカー計測に関する発展的な共同研究も進めています。これらも踏まえ、数年以内での基本システム開発を目指し、臨床現場での初期検証を達成したいと思っています。また、抗原抗体反応は一般性の高い生化学反応であることから、医療分野のみならず、飲食物中のアレルギー物質などの検査や、環境中の生物由来物質の検出、製薬プロセスでの中間生成物の検査など、多様な産業分野への展開も期待されます。
関連の成果の一部をBioJapan 2022(会期:2022年10月12-14日、会場:パシフィコ横浜)(https://jcd-expo.jp/ja/)にて展示予定です(小間番号C-47)。ご興味がある方はお立ち寄り頂ければ幸いです。
資金情報
本研究はJST未来社会創造事業「低侵襲ハイスループット光濃縮システムの開発 ( JPMJMI18GA、JPMJMI21G1)」(研究開発代表者:飯田琢也)、JST創発的研究支援事業「バイオミメティック電極による外場誘導型エコシステムの創成(JPMJFR201O)」(研究代表者:床波志保)、科研費基盤研究(A)(17H00856、21H04964)(研究代表者:飯田琢也)、大阪府立大学キープロジェクト(「LAC-SYSプロジェクト ―次世代バイオフォトニクスが拓く未来―」)などの支援の下で実施されました。
用語解説
※1 光の力(光誘起力):光が物質に及ぼす電磁気学的な力の総称。直進するレーザー光を物質に照射すれば、「押す」力を与えることができ、レンズで強く絞ったレーザー光の強度の強いスポット付近に物質を捕捉することができる。
※2 分子認識機構:水素結合、金属配位相互作用、疎水性力、分子間力、π-π相互作用、ハロゲン結合、静電気力、ファン・デル・ワールス力などの非共有結合的な比較的弱い相互作用によって、ホスト分子(本研究のプローブ粒子表面の抗体に相当)およびゲスト分子(本研究のターゲットタンパク質に相当)が高い相補性を示して選択的(特異的)に結合する機構(「鍵と鍵穴モデル」で例えられる場合もある)。本研究で対象とした抗原-抗体反応や、DNAやRNAなど核酸のハイブリダイゼーションなどが挙げられる。特に、抗原抗体反応は、抗原となるタンパク質などの抗原決定基(エピトープ)と抗体決定基(パラトープ)の結合による可逆反応で、生体内ではB細胞が異物である抗原を受取り、それに特異的に結合する抗体を産生することで液性免疫に寄与することが知られている。
※3 光誘導加速:主にレーザー光を、分子認識機構を付与したプローブ粒子や基板に照射して光の力や光誘起対流を発生させて、対象となるナノスケールおよびマイクロスケールのサイズ領域の生体関連物質を濃縮し、生体分子間の衝突確率を飛躍的に高めて分子認識を加速することで高効化する原理と技術。
掲載誌情報
| 【発表雑誌】 | Communications Biology |
| 【論 文 名 】 | Attogram-level Light-induced Antigen-antibody Binding Confined in Microflow |
| 【著 者】 | Takuya Iida, Shota Hamatani, Yumiko Takagi, Kana Fujiwara, Mamoru Tamura and Shiho Tokonami |
| 【掲載URL】 | https://doi.org/10.1038/s42003-022-03946-0 |
研究内容に関する問い合わせ先
大阪公立大学
大学院理学研究科/LAC-SYS研究所
教授/所長:飯田琢也(いいだ たくや)
TEL:072-254-8132
E-mail:t-iida[at]omu.ac.jp [at]を@に変更してください
大阪公立大学
大学院工学研究科/LAC-SYS研究所
准教授/副所長:床波志保(とこなみ しほ)
E-mail:tokonami[at]omu.ac.jp [at]を@に変更してください
報道に関する問い合わせ先
大阪公立大学 広報課
担当:國田(くにだ)
TEL:06-6605-3411
E-mail:koho-list[at]ml.omu.ac.jp [at]を@に変更してください
該当するSDGs





